Molekulárně–dynamické simulace analog nukleových kyselin
Autor: Mgr. Diana PavlováVedoucí práce: RNDr. Ivan Barvík Jr., PhD.
Konzultanti:
Typ: Magisterská
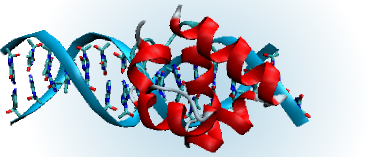
Abstrakt: Cílem této diplomové práce bylo studium interakcí lidské RNasy H s přirozeným a modifikovaným substrátem. 3-D struktura enzymu byla vytvořena na základě homologního modelování a studována pomocí molekulární dynamiky. Bylo zjištěno, že interakce se účastní 10 reziduí: DNA-vazebná jsou Ser98, Trp90, Thr46, Asn105 a Gln48; RNA-vazebná Met77, Asn47, Glu51, Cys12 a Ser14. Vysoce konzervovaný DDE motiv tvoří karbonylová rezidua Asp139, Asp75, Glu51 a Asp10, nezbytná pro stabilizaci Mg iontů v aktivním místě. Dále byl zkoumán vliv modifikací internukleotidových spojek (C3’-O3’-CH2-P-O5’-C5’ a C3’-O3’-P-CH2-O5’-C5’) v DNA vlákně na interakci s enzymem. Detailně byly prozkoumány rozdíly mezi komplexem s lidskou/E. coli RNasou H. V předchozích studiích byla u E. coli pozorována nejvýraznější narušení vodíkových vazeb mezi rezidui Trp109, Tyr78, Lys104 a Asn105 a modifikovaným substrátem. V případě lidské RNasy H však v tomto místě váže substrát pouze Asn105. To znamená, že lidská RNasa H by mohla lépe tolerovat neisosterní fosfonátová residua ve srovnání se svým protějškem z E. coli.
Klíčová slova: None